Флавоноид процианидин С1 обладает сенотерапевтической активностью и увеличивает продолжительность жизни мышей.
Абстрактный
Связанное со старением функциональное снижение органов и повышенный риск возрастных хронических патологий частично вызваны накоплением стареющих клеток, которые развивают секреторный фенотип, связанный со старением (SASP). Здесь мы показываем, что процианидин C1 (PCC1), полифенольный компонент экстракта виноградных косточек (GSE), увеличивает продолжительность жизни и продолжительность жизни мышей за счет своего воздействия на стареющие клетки. Путем скрининга библиотеки натуральных продуктов мы обнаружили, что GSE и PCC1 как один из его активных компонентов оказывают специфическое действие на стареющие клетки. В низких концентрациях PCC1, по-видимому, ингибирует образование SASP, тогда как он избирательно убивает стареющие клетки при более высоких концентрациях, возможно, за счет производства активных форм кислорода и митохондриальной дисфункции. В моделях грызунов PCC1 истощает стареющие клетки в микросреде опухоли, поврежденной лечением, и повышает терапевтическую эффективность при совместном введении с химиотерапией. Периодическое введение PCC1 облученным, имплантированным стареющим клеткам или старым мышам естественного возраста облегчает физическую дисфункцию и продлевает выживаемость. Мы идентифицируем PCC1 как естественный сенотерапевтический агент с активностью in vivo и высоким потенциалом для дальнейшего развития в качестве клинического вмешательства для отсрочки, облегчения или предотвращения возрастных патологий.
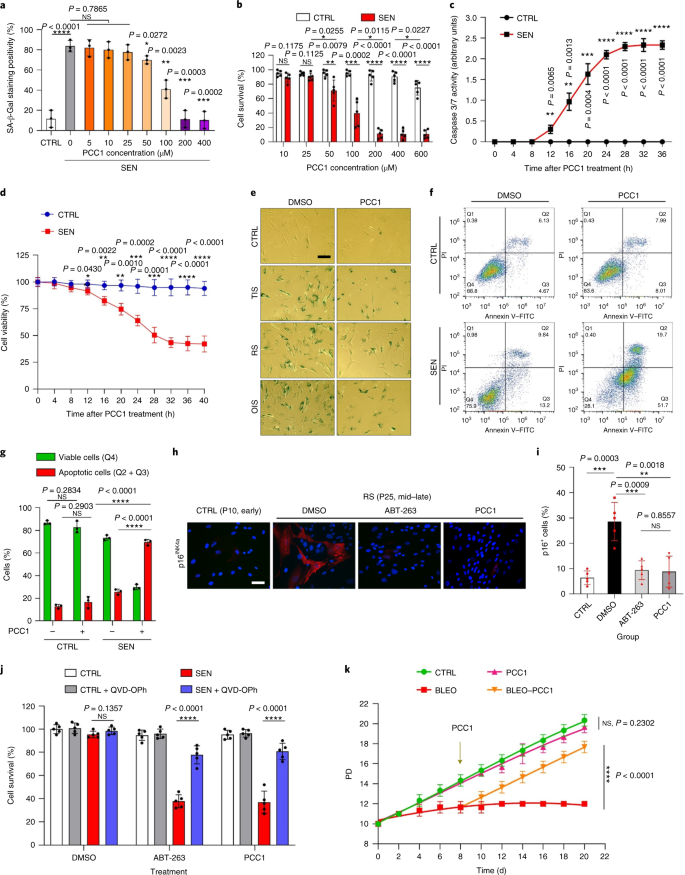
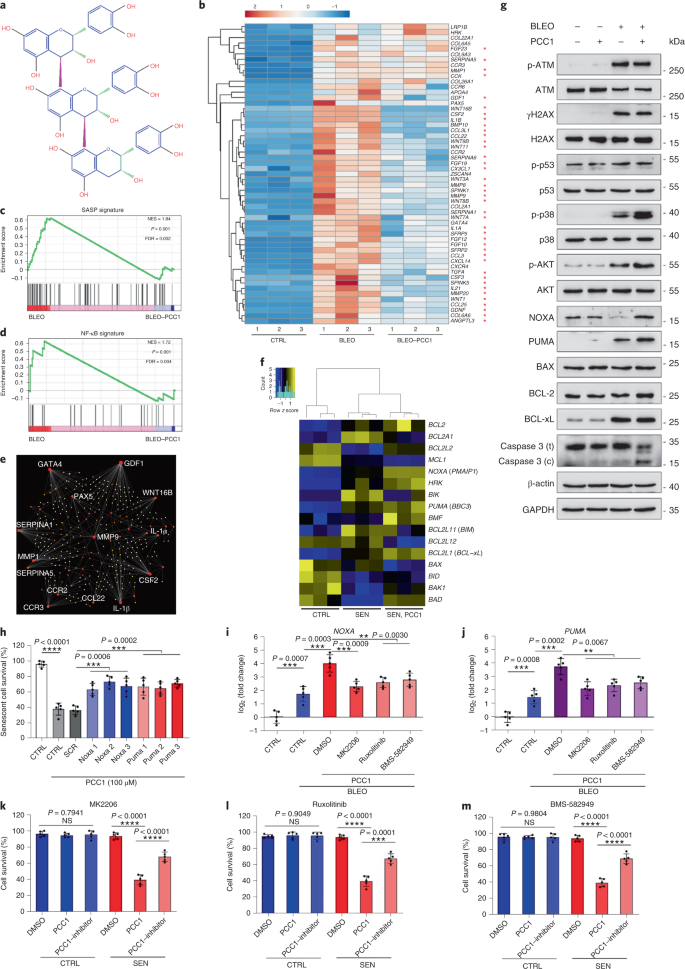
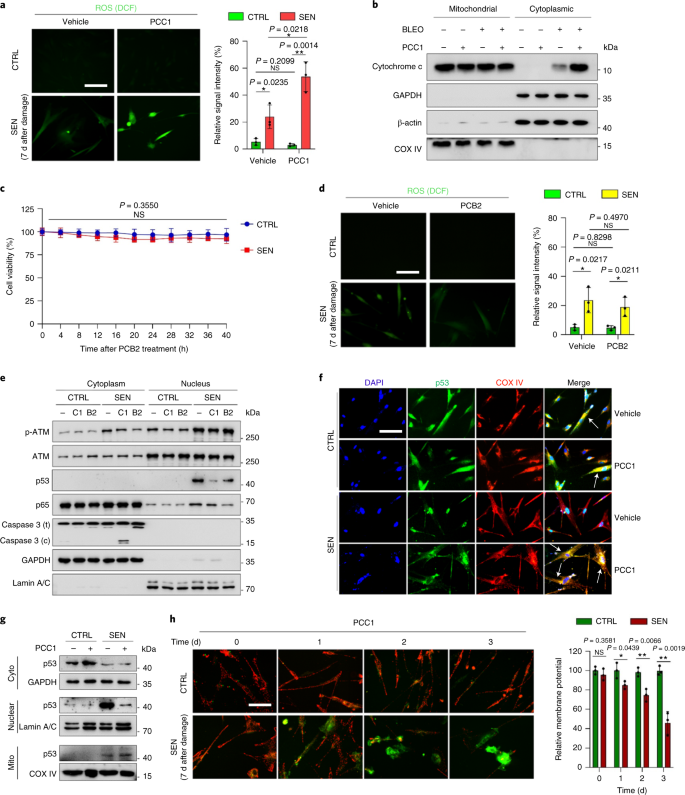
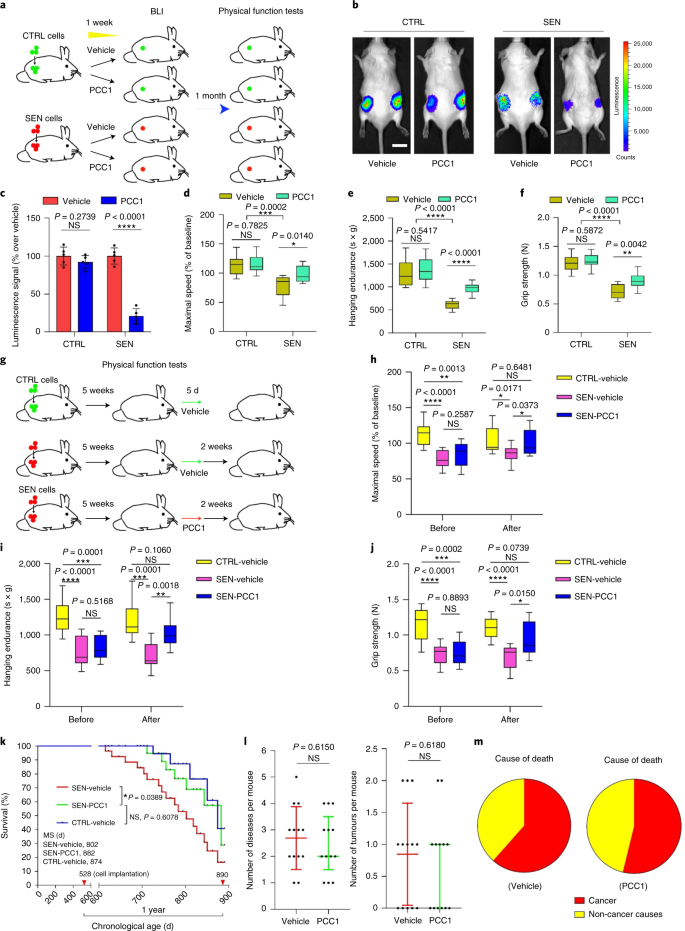
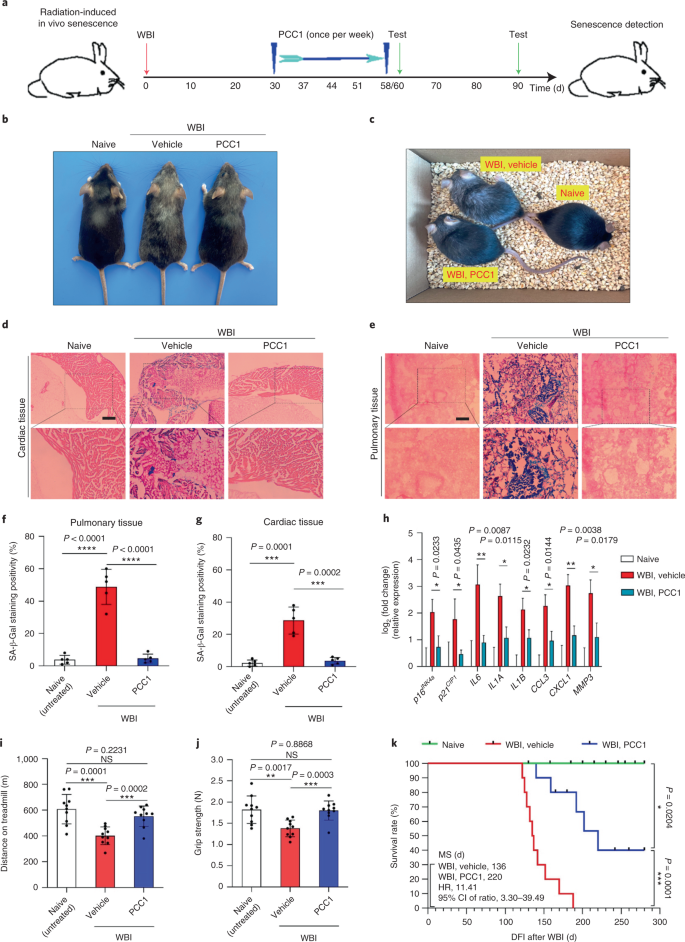
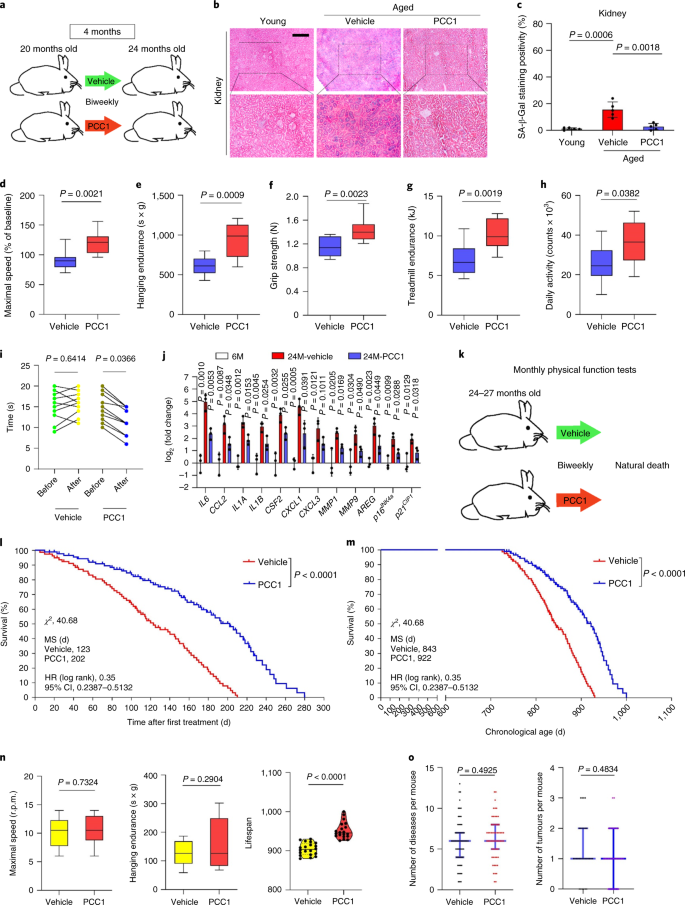
Старение является одним из самых больших факторов риска хронических заболеваний, включая сердечно-сосудистые заболевания, нарушения обмена веществ, нейродегенеративные патологии и различные злокачественные новообразования, на которые в совокупности приходится основная часть заболеваемости, смертности и затрат на здоровье во всем мире.1. За последние годы был достигнут значительный прогресс в разработке конкретных средств для лечения отдельных возрастных состояний, таких как диабет 2 типа, остеопороз, хрупкость скелета и сосудистая дисфункция. Однако совокупный эффект этих препаратов в борьбе с заболеваемостью и смертностью от хронических заболеваний был умеренным, и эти заболевания, как правило, возникают синхронно как мультиморбидные, причем их распространенность экспоненциально возрастает после 70 лет.2. Несколько основных факторов, влияющих на продолжительность здоровья и продолжительность жизни, были выявлены в ходе исследований на различных видах и определены как механизмы старения, которые можно разделить на девять отличительных признаков.3. Из этих фундаментальных механизмов старения значительное внимание уделяется клеточному старению, поскольку оно представляет собой поддающийся воздействию лекарств процесс, который предотвращает или задерживает множественные сопутствующие заболевания старения.4. Клеточное старение, о котором впервые было сообщено в 1960-х годах, относится к клеточному состоянию, включающему по существу необратимую остановку репликации, глубокие изменения хроматина, устойчивость к апоптозу и усиление синтеза белка, часто приводящее к перепроизводству провоспалительных цитокинов, характеристику, называемую SASP, которая, как считается, управлять фенотипами старения и различными возрастными патологиями5. Удаление стареющих клеток, положительных по маркеру старения p16INK4A смягчает дегенерацию тканей и увеличивает продолжительность жизни животных, поддерживая утверждение, что стареющие клетки играют причинную роль в старении организма6,7. Успех доклинических исследований вдохновил на начало клинических испытаний, подтверждающих правильность концепции, с участием сенолитиков для лечения нескольких заболеваний человека с потенциалом снижения нагрузки стареющих клеток in vivo за счет селективного фармакологического устранения.8,9,10. С момента первого открытия в 2015 году (исх. 11), сейчас известно несколько синтетических или низкомолекулярных сенолитических агентов. Стратегии нацеливания в основном основаны на механизме устойчивости стареющих клеток к апоптозу, который, по-видимому, зависит от антиапоптотических путей, связанных со старением, которые позволяют выжить стареющим клеткам в течение продолжительных периодов времени.12,13. Периодическое введение сенолитиков может снизить риск развития у пациентов неблагоприятных состояний, свести к минимуму побочные эффекты лекарств и предотвратить развитие лекарственной устойчивости стареющих клеток, которые не делятся, что отличает их от раковых клеток, поскольку раковые клетки часто приобретают полезные мутации, обеспечивающие устойчивость к противоопухолевой терапии. Однако большинство зарегистрированных сенолитиков зависят от клеточного происхождения или типа клеток или, альтернативно, проявляют значительную цитотоксичность in vivo, что ограничивает их потенциальное использование в клинических целях. В этом исследовании мы проверили медицинскую библиотеку натуральных продуктов, состоящую из антивозрастных агентов, и определили несколько кандидатов, включая GSE. Дальнейший анализ показал, что PCC1, эпикатехиновый компонент тримера B флавоноидов GSE, играет главную роль в подавлении экспрессии SASP при низких концентрациях и уничтожении стареющих клеток при более высоких концентрациях, причем последнее происходит за счет индукции апоптоза. Доклинические данные показали, что в сочетании с классической химиотерапией PCC1 может значительно уменьшить размер опухоли и продлить выживаемость на нескольких моделях мышей. Таким образом, PCC1 представляет собой новый класс фитохимических сенолитиков, выделенных из природных источников, которые замедляют старение и улучшают возрастные расстройства и требуют дальнейшего изучения в качестве потенциального геропротекторного агента в клинической медицине. В попытке идентифицировать новые соединения, которые могут эффективно модулировать стареющие клетки, был проведен беспристрастный скрининг агентов с помощью фитохимической библиотеки, состоящей из 46 лекарственных агентов растительного происхождения (библиотека PDMA). Мы использовали первичную нормальную линию стромальных клеток простаты человека, PSC27, в качестве клеточной модели для этой цели. Состоящий в основном из фибробластов, но с незначительным процентом нефибробластных клеточных линий, включая эндотелиальные клетки и гладкомышечные клетки, PSC27 сам по себе является первичной линией клеток и развивает типичный SASP после воздействия стрессоров, таких как генотоксическая химиотерапия или ионизирующее излучение.14,15,16,17. Мы обработали эти клетки предварительно оптимизированной сублетальной дозой блеомицина (50 мкг / мл.−1) и наблюдали усиление окрашивания связанной со старением β-галактозидазы (SA-β-Gal), снижение включения 5-бромдезоксиуридина и усиление очагов репарации повреждений ДНК (DDR) через 7-10 дней после (дополнительный рис. 1а - в). Мы разработали стратегию скрининга, чтобы сравнить влияние отдельных лекарственных средств на выживаемость и профиль экспрессии стареющих клеток (расширенные данные, рис. 1а). Одним из многообещающих преимуществ сенолитических агентов является избирательная индукция запрограммированной гибели стареющих клеток, таких как ABT-263, ABT-737 и комбинированное применение дазатиниба и кверцетина.11,18,19. Сначала мы протестировали эффективность этих геропротекторных препаратов против стареющих клеток PSC27, чтобы продемонстрировать их потенциал в качестве экспериментальной клеточной модели для скрининга лекарств. Наши предварительные данные свидетельствуют о том, что каждое из этих соединений значительно истощает стареющие клетки, но не пролиферирует клетки, что подтверждает возможность использования этой стромальной линии для дальнейших исследований (расширенные данные, рис. 1b). После крупномасштабного скрининга библиотеки PDMA мы идентифицировали несколько соединений, способных избирательно убивать стареющие клетки в культуре (расширенные данные, рис. 1c-e). Среди агентов, демонстрирующих предварительные эффекты против старения, были GSE, кверцетин, физетин, куркумин и пиперлонгумин (расширенные данные, рис. 1г, д). Кверцетин и физетин имеют схожие химические структуры, обладают схожими лечебными эффектами и оба являются известными сенолитиками.11,20,21. Куркумин и пиперлонгумин также являются природными соединениями с недавно обнаруженным сенолитическим потенциалом.22,23. Мы решили сосредоточиться на GSE, который оставался в значительной степени малоизученным источником. В условиях in vitro GSE подавлял SASP с максимальной эффективностью при 0,1875 мкг / мл.−1 (Расширенные данные рис. 2а), что соответствует свойству сеноморфизма24. Более низкие или более высокие концентрации GSE были менее эффективными, возможно, из-за индукции клеточных стрессовых реакций в результате повышенной цитотоксичности (расширенные данные, рис. 2а). Используя RNA-seq, мы обнаружили, что обработка GSE значительно изменяла профиль экспрессии клеток старения: 2644 гена подавлялись, а 1472 гена усиливались при изменении в 2,0 раза на ген (п <0,01) (расширенные данные рис. 2b). Хотя экспрессия нескольких генов, не связанных с SASP, показала сходную тенденцию с экспрессией типичных факторов SASP (расширенные данные, рис. 2c), данные нашего анализа обогащения набора генов (GSEA) подтвердили снижение экспрессии молекулярных сигнатур SASP или активацию комплекса ядерного фактора (NF) -κB, который является ключевым медиатором провоспалительного фенотипа (расширенные данные рис. 2г, д). Ядерная транслокация p65, одной из основных субъединиц комплекса NF-κB, наблюдалась в стареющих клетках, что согласуется с его функциональным участием в экспрессии SASP.14 (Расширенные данные рис. 2f). Следует отметить, что GSE в низких концентрациях (например, 0,1875 мкг / мл) существенно противодействовал этой тенденции.−1). Напротив, активация передачи сигналов NF-κB не подавлялась, а, скорее, казалась усиленной, когда GSE использовался в более высоких концентрациях (например, 3,7500 мкг / мл).−1), предполагая дифференциальные ответы стареющих клеток в этих условиях лечения. Активация передачи сигналов DDR, о чем свидетельствует фосфорилирование киназы ATM в ядерных фракциях, и экспрессия хемокинового лиганда мотива C – X – C (CXCL) 8, одного из определяющих факторов SASP, наблюдаемого в цитоплазматических фракциях, соответствовали NF -κB активация в этих настройках (Расширенные данные рис. 2f). Профили белок-белковых взаимодействий выявили высокоактивную сеть, включающую множество факторов, значительно активизирующуюся при клеточном старении, но снижающуюся, как только клетки подвергались воздействию GSE (расширенные данные, рис. 3a). Профилирование генной онтологии показало, что эти молекулы функционально вовлечены в биологические процессы и связаны с клеточными компонентами, что в целом соответствует секретируемой природе SASP (расширенные данные, рис. 3б, в). Таким образом, GSE - это натуральный продукт, который может контролировать провоспалительный профиль стареющих клеток, SASP, при использовании в определенном диапазоне концентраций. Хотя GSE был не единственным натуральным продуктом с сенолитической эффективностью в наших клеточных анализах (расширенные данные, рис. 1г, д), наше последующее исследование в основном было сосредоточено на GSE, так как его геропротекторная способность оказалась особенно поразительной. Учитывая эффективность GSE в снижении SASP в качестве сеноморфного агента, мы затем исследовали потенциал этого природного продукта в уничтожении стареющих клеток в более высоких концентрациях, действуя как сенолитик. Окрашивание SA-β-Gal показало, что стареющие клетки элиминировались при концентрации GSE 0,75 мкг / мл.−1 (Инжир. 1а, б). 3,75 мкг / мл−1 GSE, было достигнуто плато 20% выживаемости стареющих клеток (рис. 1а, б). а, Количественная оценка выживаемости стареющих клеток PSC27 по положительности SA-β-Gal. GSE вносили в среду в возрастающих концентрациях. CTRL - контрольные (пролиферирующие) клетки; SEN - стареющие клетки; NS, не имеет значения. п значения были рассчитаны с помощью однофакторного дисперсионного анализа с тестом множественного сравнения Тьюки. бРепрезентативные изображения, демонстрирующие окрашивание SA-β-Gal после обработки клеток PSC27 различными концентрациями GSE. Масштабная линейка, 20 мкм. Данные представляют из трех независимых экспериментов. ДМСО, диметилсульфоксид. c, Анализ выживаемости контрольных и стареющих клеток PSC27 после обработки GSE (в концентрациях 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 и 15,0000 мкг / мл.−1, соответственно). Данные представлены как среднее ± стандартное отклонение и были получены из трех биологических повторов (п = 3 независимых анализа). п значения рассчитывались двусторонним т-тесты. d, Измерение динамики жизнеспособности in vitro при обработке контрольных и стареющих клеток PSC27 GSE (3,75 мкг мл−1). Данные представлены как среднее ± стандартное отклонение и были получены из трех биологических повторов (п = 3 независимых эксперимента). п значения рассчитывались двусторонним т-тесты. И, Измерение проточной цитометрии контрольных и стареющих клеток PSC27 после обработки с помощью набора аннексина V – FITC и пропидия йодида (PI) и окрашивания 4,6-диамидино-2-фенилиндолом (DAPI) для определения степени апоптоза. Q1 – Q4, 1–4 квартили. ж, Сравнительная количественная оценка процента жизнеспособных (Q4, PI-annexin V-) и апоптотический (Q2 и Q3, PI+annexin V+ и ИП-annexin V+соответственно) клетки в контрольных или стареющих популяциях, обработанных носителем или GSE в течение 3 дней (п = 3 биологически независимых анализа). п значения рассчитывались двусторонним т-тесты. г, Измерение сигнала флуоресценции MitoSOX Red, индикатора митохондриального супероксида, в клетках PSC27 в различных условиях. п значения рассчитывались двусторонним т-тесты. час, Масс-спектры высокого разрешения, показывающие общую ионную хроматограмму (TIC) и хроматограмму основного пика GSE после выполнения HPLC – ESI-QTOF-MS. Если не указано иное, клетки подвергали соответствующему анализу через 3 дня после обработки GSE в условиях культивирования. cps, отсчетов в секунду. Данные на гистограммах и кривых регрессии показаны как среднее ± стандартное отклонение и представляют три биологических повтора. NS, п > 0,05; *п <0,05; **п <0,01; ***п <0,001; ****п <0,0001. Анализы жизнеспособности клеток показали, что GSE индуцировал гибель стареющих клеток, но не гибель пролиферирующих клеток, начиная с концентрации 0,75 мкг / мл.−1 (Инжир. 1c). При концентрации 7,50 мкг мл−1процент выживших стареющих клеток снизился примерно до 10%, тогда как жизнеспособность пролиферирующих клеток не пострадала даже при 15,00 мкг / мл.−1 GSE (рис. 1c), самая высокая концентрация, используемая в наших клеточных анализах, что свидетельствует о выдающейся селективности и специфичности GSE против стареющих клеток, которые являются основными чертами сенолитиков. Затем мы измерили способность GSE по-разному воздействовать на стареющие клетки с течением времени. После обработки GSE в концентрации 3,75 мкг / мл−1, жизнеспособность стареющих клеток существенно не снижалась до 20 часов. Разница в жизнеспособности стареющих клеток и контроля (пролиферирующих клеток) достигла максимума через 32 часа, что предполагает гетерогенность внутренней устойчивости к сенолитикам в популяциях стареющих клеток (рис. 1д). Поскольку GSE оказывает явное действие на стареющие клетки, мы проанализировали эффективность GSE в индукции апоптоза клеток. Проточная цитометрия продемонстрировала значительное снижение жизнеспособности, в то время как апоптоз стареющих клеток, но не пролиферирующих клеток, был повышенным (рис. 1e, f и дополнительный рис. 2а). Дисфункция митохондрий и метаболические изменения являются одними из признаков стареющих клеток и старения организма, событий, вызывающих окислительный стресс и производство активных форм кислорода (АФК), таких как супероксид.3,25. Мы использовали MitoSOX Red, индикатор митохондриального супероксида.26, чтобы исследовать межклеточные изменения, и обнаружили, что GSE способствует генерации митохондриальных АФК в стареющих клетках, но не в пролиферирующих клетках (рис. 1 г). Таким образом, наши данные согласуются с моделью, в которой GSE убивает стареющие клетки посредством индукции апоптоза и обострения митохондриального стресса in vitro. Семена винограда составляют 38–52% по сухому веществу винограда и являются обильным источником антиоксидантов.27. Мы применили жидкостную хроматографию высокого давления (ВЭЖХ) в сочетании с квадрупольной времяпролетной масс-спектрометрией (QTOF-MS), оснащенной интерфейсом ионизации электрораспылением (ESI), для идентификации основных компонентов GSE. Мы обнаружили три основные категории фитохимических веществ, включая фенольные кислоты, флавоноиды (такие как флаван-3-ол, процианидины) и другие соединения (рис. 1 час и дополнительная таблица 1). Среди них несколько компонентов были идентифицированы как процианидины и их производные, которые, как сообщалось, нацелены на митохондриальные белки и облегчают множественные хронические заболевания.28. Однако основные компоненты, опосредующие сенолитическую функцию GSE, остаются в значительной степени неясными. Сообщаемая биологическая активность процианидинов виноградных косточек включает уменьшение окислительного повреждения, подавление воспаления и индукцию апоптоза раковых клеток.29,30,31,32. Среди отдельных соединений, обнаруженных в GSE, особого внимания заслуживает PCC1, поскольку было показано, что он вызывает повреждение ДНК, вызывает остановку клеточного цикла и увеличивает экспрессию киназ контрольных точек.33. Данные предварительного анализа (общая ионная хроматограмма) GSE, смеси фитохимических агентов как таковой, с помощью HPLC – QTOF-MS предполагают присутствие PCC1, поскольку профиль GSE на определенных пиках MS совпадает с профилем хроматограммы химически чистого PCC1 приобретены из коммерческого источника (рис. 1 час и дополнительный рис. 2b). Было показано, что PCC1 снижает уровень BCL-2, но увеличивает экспрессию регулятора BAX и активность каспаз 3 и 9 в культивируемых раковых клетках, потенциально вызывая противораковые эффекты за счет индукции апоптоза.33. Следовательно, мы затем оценили способность и селективность PCC1 устранять стареющие клетки в культуре. Данные свидетельствуют о том, что PCC1 является сенолитическим для стареющих стромальных клеток, начиная с концентрации 50 мкМ, при которой пролиферирующие клетки остаются в значительной степени незатронутыми (рис. 2а, б и дополнительная таблица 2). Хотя более высокие концентрации вызывали более низкую выживаемость стареющих клеток, с порогом примерно 200 мкМ, PCC1 проявлял токсичность по отношению к контрольным клеткам только при использовании в 600 мкМ или выше (рис. 2b). Динамика активности каспазы 3/7 показала, что PCC1 проявляет апоптотические эффекты в течение 12 часов, достигая плато через 24 часа (рис. 2c). Этот результат во многом согласуется с измерениями жизнеспособности (рис. 2d). Сенолитическая природа PCC1 была подтверждена клетками, которые вступили в стадию старения из-за репликативного истощения или старения (RS) или онкогена (HRAS).G12V) сверхэкспрессия (OIS), которая вызывает стрессовые инсульты, подобные таковым при старении, вызванном терапией (рис. 2e, Расширенные данные Рис. 4б - д и дополнительная таблица 2). В совокупности результаты предполагают, что PCC1 селективно очищает стареющие стромальные клетки человека, вызванные различными стимулами, в зависимости от дозы, но без значительного воздействия на незрелые клетки при использовании в соответствующих концентрациях. а, Измерение выживаемости стареющих клеток PSC27 путем окрашивания SA-β-Gal. PCC1 применяли в возрастающих концентрациях. п значения были рассчитаны с помощью однофакторного дисперсионного анализа с тестом множественного сравнения Тьюки. бВыживание стареющих клеток PSC27, индуцированных блеомицином при увеличении концентрации PCC1. c, Апоптотический анализ активности каспазы 3/7. dКривые зависимости выживаемости от времени для оценки жизнеспособности клеток PSC27 после обработки PCC1. И, Изображения окрашивания SA-β-Gal. TIS, старение, вызванное терапией (блеомицином). Масштабная линейка, 20 мкм. Данные представляют из трех независимых экспериментов. ж, Проточная цитометрия после обработки с помощью набора аннексин V – FITC и PI и окрашивания DAPI для определения уровней апоптоза. г, Количественное определение процента жизнеспособных (Q4, PI-annexin V-) и апоптотический (Q2 и Q3, PI+annexin V+ и ИП-annexin V+соответственно) клетки после обработки носителем или PCC1 в течение 3 дней (п = 3 биологически независимых анализа). час, Иммунофлуоресцентное окрашивание клеток PSC27. RS индуцировали последовательным пассированием перед обработкой PCC1. Красный, стр. 16INK4a. Клетки на раннем пассаже (P10) использовали в качестве отрицательного контроля. ABT-263 (1,25 мкМ) тестировали в качестве положительного контроля. Масштабная линейка, 20 мкм. я, Статистика иммунофлуоресцентного окрашивания. j, PCC1-индуцированная сенолитическая активность после ингибирования панкаспазы (20 мкМ QVD-OPh). к, PD-анализ МСК человека. PCC1 применяли на 8-й день после начала экспериментов, как указано. БЛЕО, блеомицин. За c,d,к, данные показаны как среднее ± стандартное отклонение и были получены из трех биологических повторов (п = 3 независимых анализа). Для данных в б-d,г,я,j, п значения рассчитывались двусторонним т-тесты. В экспериментах для c-к, PCC1 использовали в концентрации 100 мкМ. Если не указано иное, образцы собирали для анализов через 3 дня после обработки PCC1. Данные на гистограммах показаны как среднее ± стандартное отклонение и представляют три биологических повтора. NS, п > 0,05; *п <0,05; **п <0,01; ***п <0,001; ****п <0,0001. Чтобы экспериментально расширить и установить эффективность PCC1 во всех клеточных клонах, мы обработали фибробласты легких плода человека (WI38), первичные эндотелиальные клетки пупочной вены (HUVEC) и мезенхимальные стволовые клетки человека (MSC) с помощью PCC1 и обнаружили, что стареющие клетки всех этих клонов проявляют аналогичная восприимчивость к селективной абляции PCC1, тогда как их несвежие аналоги оставались жизнеспособными (расширенные данные, рис. 4f – h и дополнительная таблица 3). Мы также подтвердили индукцию апоптоза в стареющих клетках в ответ на PCC1 с помощью проточной цитометрии, в то время как пролиферирующие клетки оставались в значительной степени незатронутыми PCC1 (рис. 2f, г). В целом, наши данные показывают, что PCC1 избирательно устраняет стареющие клетки из разных типов клеток и возникающие в результате различных триггеров старения. Чтобы визуализировать истощение стареющих клеток PCC1, мы исследовали экспрессию p16INK4a, широко используемый маркер старения в стромальных клетках, испытавших RS. PCC1 эффективно удалял p16-положительные стареющие клетки, которые появлялись только в популяциях позднего пассажа PSC27, с эффективностью, в значительной степени напоминающей эффективность ABT-263 (1,25 мкМ), хорошо зарекомендовавшего себя синтетического сенолитического агента.18,21 (Инжир. 2ч, я). Чтобы подтвердить, что PCC1-опосредованная элиминация стареющих клеток происходит в основном за счет индукции апоптоза, а не за счет других форм запрограммированной гибели клеток, мы обработали клетки ингибитором апоптоза панкаспазы хинолил-валил-В-метиласпартил - (- 2,6-дифторфенокси) метилкетон (QVD-OPh). QVD-OPh обращает способность PCC1 убивать стареющие клетки. Таким образом, PCC1 разделяет свою каспазозависимую индукцию апоптоза как сенолитический признак с ABT-263 (рис. 2j). Дальнейший анализ с химическими ингибиторами исключил гибель клеток, вызванную PCC1, в результате ферроптоза, пироптоза или некроптоза (расширенные данные, рис. 4i). Чтобы оценить потенциал удвоения популяции клеток (PD) после лечения генотоксичными препаратами, мы использовали МСК, которые могут самообновляться и возобновлять пролиферацию на основе колоний даже после воздействия стрессов окружающей среды.34, вероятно, из-за гетерогенности повреждений, при этом клетки, испытывающие меньшее повреждение, предположительно способны сохранять потенциал для самовосстановления и повторного входа в клеточный цикл24,35. В отличие от поврежденных блеомицином клеток, рост которых после обработки быстро прекращался, обработка PCC1 после старения значительно увеличивала способность МСК к PD, особенно после удаления стареющих клеток, развивающих SASP и сохраняющих потенциал для индукции паракринного старения в популяциях клеток (рис. . 2k). Однако обработка PCC1 не влияла на PD пролиферирующих клеток, что дополнительно свидетельствует о селективности PCC1 для стареющих клеток по сравнению с их нормальными аналогами. Поскольку GSE представляет собой сложную фитохимическую смесь, многие из ее компонентов обладают антиоксидантной и противовоспалительной активностью.27,36мы исследовали, является ли PCC1 основным компонентом GSE, участвующим в истощении стареющих клеток, или же альтернативные фитохимические вещества в GSE могут способствовать его общему сенолитическому эффекту. С этой целью мы исследовали влияние отдельных фитохимических молекул на выживаемость стареющих клеток PSC27. Большинство компонентов GSE не проявляют сенолитической активности в диапазоне доз PCC1 и не вызывают значительной гибели пролиферирующих клеток (дополнительные фиг. 3 и 4). Хотя флавоноид кверцетин проявлял сенолитическую активность, как и в наших предыдущих исследованиях, свойство, разделяемое с натуральными флавонами.11,21, «восстановленный GSE», состоящий из основных компонентов, смешанных в соответствии с их массовым процентным содержанием, как показано нашими данными HPLC – QTOF-MS (дополнительная таблица 1, обратите внимание, что кверцетин составляет всего 0,9%), но целенаправленно исключая PCC1, не показал результатов, аналогичных результатам, наблюдаемым для PCC1 в обоих анализах (дополнительные фиг. 3 и 4). Хотя мы не можем сделать вывод о том, вносят ли вклад другие компоненты, наши данные ясно показывают, что PCC1 является первичным медиатором сенолитического эффекта GSE. Учитывая выдающуюся эффективность PCC1 в избирательном индуцировании гибели стареющих клеток, мы исследовали лежащие в основе механизмы. PCC1 принадлежит к суперсемейству флавоноидов, которые могут улавливать свободные радикалы, хелатировать металлы и уменьшать образование гидропероксидов, антиоксидантные свойства, приписываемые функциональной группе '-OH' в структуре и ее положению в кольце молекулы флавоноида.27. Антиоксидантная способность процианидинов частично определяется степенью их полимеризации, в то время как PCC1 по своей природе является тримером процианидин-эпикатехина (рис. 3a). а, Химическая структура тримерного эпикатехина PCC1. б, Тепловая карта, показывающая верхние гены (50), значительно повышенная в стареющих клетках PSC27, но подавляющаяся при обработке PCC1 (50 мкМ). Красные звезды, факторы SASP. c, График GSEA значимого набора генов в спектре SASP. FDR - коэффициент ложного обнаружения; NES, нормализованная оценка обогащения. d, График GSEA значительного набора генов, связанных с передачей сигналов, опосредованной NF-κB. ИКарта NetworkAnalyst белок-белковых взаимодействий типичных SASP-ассоциированных факторов значительно усиливается в стареющих клетках, но подавляется обработкой PCC1. ж, Тепловая карта, показывающая дифференциальную экспрессию генов семейства BCL-2 в контрольных, стареющих и стареющих клетках, обработанных PCC1. г, Иммуноблоттинг клеток PSC27, подвергнутых действию различных агентов. Была исследована экспрессия проапоптотических и антиапоптотических факторов и молекул, связанных с передачей сигналов DDR. Каспаза 3 (t), общая каспаза 3; каспаза 3 (с), расщепленная каспаза 3; p, фосфорилированный. β-актин и GAPDH, контроль загрузки. Данные представляют из трех независимых экспериментов. час, Клетки инфицировали тремя разными видами коротких шпилечных РНК, нацеленных на ТРАВМА, ПОВРЕЖДЕНИЕ или PUMA перед воздействием блеомицина, чтобы вызвать старение. Через семь дней клетки обрабатывали PCC1 (100 мкМ) в течение 3-х дней для индукции апоптоза. SCR, схватка. я, ТРАВМА, ПОВРЕЖДЕНИЕ экспрессию определяли с помощью количественной ПЦР с обратной транскрипцией (RT – qPCR). Клетки обрабатывали блеомицином для индукции старения перед воздействием 100 мкМ PCC1 в течение 3 дней в отсутствие или в присутствии 10 мкМ MK2206, 10 мкМ руксолитиниба или 20 нМ BMS-582949 для ингибирования активности AKT, JAK1 и / или JAK2 или p38. МАПК соответственно. j, Аналогичный набор тестов экспрессии RT – qPCR для PUMA используя условия, описанные в я. к-м, Измерение жизнеспособности клеток после обработки PCC1 в отсутствие или в присутствии MK2206 (к), руксолитиниб (L) или BMS-582949 (м), включенные для ингибирования ферментативной активности AKT, JAK1 и / или JAK2 или p38 MAPK, соответственно. Для данных в c,d, п значения рассчитывали с помощью однофакторного дисперсионного анализа с апостериорным сравнением Тьюки. Статистическая значимость в час-м был рассчитан с использованием двустороннего т-тесты или односторонний дисперсионный анализ (тест Даннета). Данные на всех гистограммах показаны как среднее ± стандартное отклонение и представляют три биологических повтора. NS, п > 0,05; *п <0,05; **п <0,01; ***п <0,001; ****п <0,0001. Сначала мы проанализировали влияние PCC1 на транскриптомную экспрессию стареющих клеток. Биоинформатика показала, что 4406 генов были значительно активированы, а 2766 генов были подавлены в стромальных клетках после обработки PCC1 (дополнительный рис. 5а). Мы наблюдали большой набор факторов SASP, экспрессия которых заметно повышалась во время клеточного старения, но существенно снижалась, когда стареющие клетки подвергались воздействию PCC1 (рис. 3b). Профилирование GSEA показало, что сигнатуры SASP и NF-κB заметно подавлялись обработкой PCC1 (рис. 3в, г). Мы также заметили множественные взаимные взаимодействия или функциональные связи между этими факторами, которые усиливаются во время старения и снижаются после лечения PCC1, появляющиеся в списке самых дифференциально экспрессируемых генов, большинство из которых обычно были секретируемыми факторами (рис. 3e). Чтобы понять избирательность PCC1 для стареющих клеток, мы дополнительно оценили профиль транскриптомной экспрессии и заметили, что PCC1 индуцировал изменения экспрессии в нескольких членах надсемейства BCL-2 (рис. 3f). Хотя передача сигналов DDR оставалась в значительной степени незатронутой, наблюдалась PCC1-зависимая активация или активация митоген-активируемой протеинкиназы p38 (MAPK), при этом в этих клетках происходило расщепление каспазой 3 (рис. 3g). Хотя экспрессия BCL-xL была повышена в стареющих клетках по сравнению с их пролиферирующими контролями, обработка PCC1 не приводила к дальнейшему повышению уровня его белка. Уровни двух других факторов BCL-2, а именно BCL-2 и BAX, практически не изменились. В то время как NOXA и PUMA (два члена подсемейства 3 (BH3) гомологии BCL-2 - только проапоптотические) проявляли разные паттерны экспрессии во время клеточного старения, обработка PCC1 приводила к усилению активности обоих факторов (рис. 3g). Нокдаун проапоптотических факторов BCL-2 предполагает, что NOXA и PUMA частично опосредуют сенолитическое действие PCC1 (рис. 3ч и расширенные данные Рис. 5a – c). Обработка химическими ингибиторами AKT-киназы, Janus-киназы (JAK) 1, JAK2 и передачи сигналов p38 MAPK также предполагала участие этих сигнальных путей в экспрессии PMAIP1 (ТРАВМА, ПОВРЕЖДЕНИЕ) и BBC3 (PUMA) и апоптоз стареющих клеток после обработки PCC1 (рис. 3i – m). Как сбивает ТРАВМА, ПОВРЕЖДЕНИЕ и PUMA только частично подавлял сенолитический эффект PCC1 (рис. 3ч, к - м), мы исследовали другие возможные механизмы, приводящие к гибели стареющих клеток. Поскольку процианидины обычно повышают жизнеспособность клеток, снижают продукцию АФК и сдерживают окислительный стресс в клетках млекопитающих.37,38, мы затем спросили, могут ли подобные или антиоксидантные эффекты наблюдаться в стареющих клетках, подвергнутых воздействию PCC1. Неожиданно мы обнаружили обратное, поскольку стареющие клетки PSC27 демонстрировали повышенные уровни АФК при обработке PCC1, в отличие от их пролиферирующих аналогов (рис. 4a и расширенные данные Рис. 5dобратите внимание на сигналы от зонда 2'-7'-дихлородигидрофлуоресцеина диацетата (DCFH-DA)). Лечение HS-1793, стабильным аналогом ресвератрола, который обладает активностью улавливания свободных радикалов39, эффективно блокирует продукцию ROS в стареющих клетках, обработанных PCC1 (расширенные данные, рис. 5д, е), в то время как уровни АФК еще больше увеличивались после воздействия на обработанные PCC1 стареющих клеток CCCP, протонофорного митохондриального разобщителя40, или руксотемитид (LTX-315), амфипатический катионный пептид, который индуцирует проницаемость внешней митохондриальной мембраны41, каждый из которых применялся в концентрациях, которые не были цитотоксичными по отношению к контрольным клеткам (расширенные данные, рис. 5д, е). Хотя лечение CCCP или руксотемитидом само по себе также вызывало усиленную продукцию ROS, эффекты, как правило, были меньше, чем эффекты, вызванные PCC1, что позволяет предположить, что PCC1 запускает митохондриальную дисфункцию в стареющих клетках. Измеряя индекс апоптоза стареющих клеток (активность каспазы 3/7), мы обнаружили, что эффект, индуцированный PCC1, может быть дополнительно усилен при комбинации PCC1 с каждым разрушителем митохондрий, но подавлен при совместной обработке с HS-1793 (расширенные данные рис. . 5 г). а, Измерение уровней АФК с помощью DCFH-DA, проницаемого для клеток флуоресцентного зонда, чувствительного к изменениям окислительно-восстановительного состояния клеток. Эксперименты проводили через 1 день после обработки PCC1. Слева, репрезентативные изображения. Шкала 10 мкм. Верно, статистика. DCF, дихлородигидрофлуоресцеин. б, Иммуноблоттинг после воздействия на клетки различных обработок. Распределение цитохрома с между митохондриями и цитоплазмой определяли путем выделения митохондрий из надосадочных жидкостей цитозоля через 3 дня после обработки PCC1. ЦОГ IV - это конечный фермент дыхательной цепи митохондрий и митохондриальный маркер. cКривые зависимости выживаемости от времени для оценки жизнеспособности клеток PSC27 после обработки PCB2, другим членом семейства природных процианидинов. Данные представлены как среднее ± стандартное отклонение и были получены из трех биологических повторов (п = 3 независимых анализа). d, Анализ продукции АФК проводят аналогично тому, как описано в а, за исключением того, что клетки подвергались воздействию PCB2. Масштабная линейка 10 мкм. И, Иммуноблоттинг экспрессии и распределения ATM, p53 и каспазы 3 между цитоплазмой и ядром. GAPDH и ламин A / C, контролируют загрузку цитоплазмы и ядер, соответственно. C1, PCC1; B2, PCB2. жКонфокальная микроскопия иммунофлуоресцентного окрашивания после обработки клеток носителем (ДМСО) или PCC1. Применяли первичные антитела, специфичные к p53 или COX IV. Масштабная линейка 10 мкм. г, Иммуноблот-анализ клеток PSC27, подвергнутых воздействию различных агентов. Цито, цитоплазматический; мито, митохондриальный. час, Анализ окрашивания JC-1, флуоресцентный зонд, показывающий Δψm. Сигналы измерялись в течение 3 дней. Зеленая флуоресценция указывает на мономеры JC-1 (они появляются в цитозоле после деполяризации митохондриальной мембраны и указывают на раннюю стадию апоптоза). Красная флуоресценция указывает на агрегацию JC-1 (находится в интактных митохондриях). Слева, репрезентативные изображения. Верно, статистика. И PCC1, и PCB2 использовали при 100 мкМ в соответствующих анализах. Данные в б,И-г представляют три независимых эксперимента. Статистическая значимость в а (правильно), d (справа) и час (справа) рассчитано с использованием двухстороннего т-тесты, и что в c был рассчитан с помощью однофакторного дисперсионного анализа (критерий Даннета). Данные на всех гистограммах показаны как среднее ± стандартное отклонение и представляют три биологических повтора. NS, п > 0,05; *п <0,05; **п <0,01. Высвобождение цитохрома с и нарушение митохондриальной мембраны являются внутриклеточными событиями, связанными с апоптозом, и часто действуют как прямые драйверы апоптоза.42. Наши данные предполагают, что обработка PCC1 увеличивала высвобождение цитохрома с из митохондрий в окружающее цитоплазматическое пространство (рис. 4b и расширенные данные Рис. 5ч). Высвобождение цитохрома с из митохондрий в значительной степени согласуется с биохимическими реакциями, такими как активация каспазы в стареющих клетках, обработанных PCC1 (рис. 3g). Члены семейства процианидинов обладают широким спектром фармакологических свойств, включая антиоксидантные и противовоспалительные, которые противоположны тем, которые мы наблюдали при лечении стареющих клеток с помощью PCC1. Текущие данные побудили нас задуматься, воспроизводятся ли эффекты PCC1 другими процианидинами. Процианидин B2 (PCB2) представляет собой типичный флавоноид, который существует в виде димера и снижает уровень АФК во время окислительного стресса в культивируемых клетках.43. PCB2 не смог устранить стареющие клетки (рис. 4c и дополнительные фиг. 3b и 4b) и не увеличивали продукцию АФК и не индуцировали митохондриальное высвобождение цитохрома с в стареющих клетках (рис. 4d и расширенные данные Рис. 5i). Значительное количество p65 (RelA), одной из основных субъединиц комплекса NF-κB, перемещается в ядро стареющих клеток (рис. 4e). Хотя обработка PCB2 противодействовала ядерной транслокации p65, что согласуется с его противовоспалительной способностью, этот эффект не воспроизводился PCC1 (рис. 4e). Стареющие клетки, подвергшиеся воздействию PCC1, демонстрировали заметное расщепление каспазой 3, в то время как клетки, обработанные PCB2, этого не делали, что дополнительно дифференцирует биологическую активность этих двух молекул процианидина (рис. 4e). Как фактор, который функционально регулирует судьбу клетки, p53 может индуцировать апоптоз либо путем трансактивации проапоптотических генов, либо независимым от транскрипции образом путем транслокации в митохондрии.44. Мы наблюдали повышенную ядерную транслокацию p53 при клеточном старении, паттерн заметно снижается под действием PCC1, но намного меньше, чем у PCB2 (рис. 4д, е). Поскольку ядерное исключение p53 является критическим шагом в индукции апоптоза стареющих клеток.45, мы дополнительно оценили распределение p53. Иммунофлуоресцентное окрашивание показало существенно увеличенное перекрытие p53 с субъединицей IV цитохром с-оксидазы (COX IV) (трансмембранный белковый комплекс в дыхательной электронной цепи митохондрий, часто используемый в качестве маркера резидентного белка митохондрий) в стареющих клетках, обработанных PCC1, что свидетельствует об усилении транслокации p53 в митохондриальный матрикс. Хотя мы наблюдали некоторое количество p53 в митохондриях пролиферирующих клеток, PCC1 не вызывал заметного или полного притока белка p53 в митохондриальный матрикс пролиферирующих клеток (рис. 4f). Однако в стареющих клетках уровни p53 снижались в ядрах, но повышались в митохондриях при воздействии PCC1 (рис. 4 г). Снижение митохондриального мембранного потенциала (Δψm) - это событие, которое может запускать апоптоз через митохондриально-опосредованный внутренний путь.46. Мы обнаружили, что Δψm было значительно снижено в стареющих клетках, в то время как пролиферирующие клетки оставались в основном незатронутыми в присутствии PCC1, на что указывает профиль сигналов зонда JC-1 (рис. 4ч). Таким образом, PCC1 способствует генерации АФК, запускает высвобождение цитохрома с и вызывает нарушение Δψm в стареющих клетках, события, по своей сути связанные с митохондриальной недостаточностью и функциональным стимулом апоптоза клеток. В совокупности наши экспериментальные данные предполагают, что стареющие клетки подвержены апоптозу, индуцированному PCC1, процессу, частично опосредованному ТРАВМА, ПОВРЕЖДЕНИЕ и PUMA усиление регуляции и связано с усилением продукции ROS и митохондриальной дисфункцией. Учитывая способность и селективность PCC1 устранять стареющие клетки in vitro, мы затем исследовали, можно ли использовать этот агент для вмешательства против возрастных патологий in vivo. В клинической онкологии лекарственная устойчивость ограничивает эффективность большинства противоопухолевых методов лечения, в то время как стареющие клетки часто вносят вклад в терапевтическую резистентность за счет развития in vivo SASP в микросреде опухоли, поврежденной лекарствами (TME).15,16,47. Фармакологическое устранение стареющих клеток, вызванных терапией, сводит к минимуму побочные эффекты химиотерапии и предотвращает рецидив рака у животных.48. Однако возможность PCC1-опосредованного истощения стареющих клеток первичных опухолей для повышения эффективности противоопухолевого лечения остается в значительной степени неизвестной. Во-первых, мы решили создать тканевые рекомбинанты путем смешивания клеток PSC27 с клетками PC3, которые представляют собой типичную линию клеток рака простаты с высокой степенью злокачественности, в предварительно оптимизированном соотношении (1: 4).14. Затем клетки подкожно имплантировали в задний бок мышей с диабетом без ожирения и тяжелым комбинированным иммунодефицитом (NOD – SCID). Опухоли животных измеряли в конце 8-недельного периода, а ткани собирали для патологической оценки. По сравнению с опухолями, содержащими раковые клетки PC3 и наивные стромальные клетки PSC27, ксенотрансплантаты, состоящие из клеток PC3 и стареющих клеток PSC27, демонстрировали значительно увеличенный объем, подтверждая стимулирующие рост опухоли эффекты стареющих клеток (расширенные данные, рис. 6а). Чтобы имитировать клинические условия, мы экспериментально разработали доклиническую схему, включающую генотоксические терапевтические препараты и / или сенолитики (рис. 5а). Через две недели после подкожной имплантации, когда наблюдалось стабильное поглощение опухолями in vivo, животным вводили однократную дозу митоксантрона (MIT, химиотерапевтический препарат) или плацебо в 1-й день 3-й, 5-й и 7-й недель до конца 8-недельный режим (расширенные данные рис. 6b). В отличие от группы, получавшей плацебо, введение MIT заметно задерживало рост опухоли, подтверждая эффективность MIT в качестве химиотерапевтического агента (уменьшение размера опухоли на 44,0%) (рис. 5b). Примечательно, что хотя введение PCC1 само по себе не приводило к уменьшению размера опухоли, лечение MIT с последующей доставкой PCC1 (в дозе 20 мг на кг посредством внутрибрюшинной (ip) инъекции через 2 недели после первой дозы MIT и затем вводимой раз в две недели) значительно усилило регрессию опухоли (55,2 % уменьшение размера опухоли по сравнению с одним MIT; уменьшение объема опухоли на 74,9% по сравнению с лечением плацебо) (рис. 5b). а, Иллюстративная схема доклинической схемы. Через две недели после подкожной имплантации и поглощения тканевых рекомбинантов in vivo самцы мышей NOD-SCID получали либо одиночные (моно), либо комбинированные (двойные) агенты по метрономному графику, состоящему из нескольких циклов. BLI, биолюминесцентная визуализация. б, Статистическое профилирование конечных объемов опухолей. Клетки PC3 были ксенотрансплантаты отдельно или вместе с клетками PSC27 в задний бок животных. c, Сравнительная оценка старения in vivo путем окрашивания SA-β-Gal. Опухоли после умерщвления животных препарировали и обрабатывали как замороженные срезы для гистологического окрашивания. Шкала 200 мкм. d, Графики для скрипки, отображающие сравнительную статистику окрашивания SA-β-Gal в опухолевых тканях. И, Анализ транскрипта для экспрессии in vivo нескольких канонических факторов SASP в стромальных клетках, выделенных из опухолей. Ткани животных, ксенотрансплантированных как стромальными, так и раковыми клетками, подвергали выделению с использованием микродиссекции с помощью лазерного захвата и последующим процессам. Данные являются репрезентативными для трех биологических повторов (п = 10 животных в группе). Наборы данных отображаются в виде графиков в виде прямоугольников, на которых прямоугольник простирается от 25-го до 75-го процентиля, при этом медиана отображается в виде линии посередине, а усы указывают наименьшие и наибольшие значения. ж, Профилирование транскриптов SASP в стромальных клетках. Сигналы, соответствующие каждому фактору, были нормализованы к сигналам из группы, обработанной носителем. Примечание p16INK4a также известен как CDKN2A и стр.21CIP1 также известен как CDKN1A. г, Статистическое измерение клеток с повреждением ДНК и апоптозных клеток в биопрепаратах, собранных, как описано в а,б. Значения представлены как процент клеток, положительно окрашенных с помощью иммуногистохимии (ИГХ) антителами, специфичными к гистону γH2AX или каспазе 3 (расщепленные). За б,d-г, п значения рассчитывались двусторонним т-тесты. часРепрезентативные изображения IHC каспазы 3 (расщепленной, CC3) в конце терапевтических режимов. Шкала 100 мкм. я, Сравнительная выживаемость мышей, убитых после развития тяжелой тяжелой болезни. Продолжительность выживания рассчитывалась от времени инъекции рекомбинантной ткани до гибели животного. МС, медиана выживаемости. п Значения рассчитывались с помощью двусторонних логранговых тестов (Мантеля – Кокса). Данные в c,час представляют три независимых эксперимента. Данные на всех гистограммах показаны как среднее ± стандартное отклонение и представляют три биологических повтора. Затем мы проверили, происходит ли клеточное старение в опухолевых очагах этих животных. Неудивительно, что введение MIT вызывало появление большого количества стареющих клеток в опухолевой ткани. Однако доставка PCC1 этим получавшим химиотерапию животным истощила большинство стареющих клеток (рис. 5в, г). Микродиссекция с помощью лазерного захвата с последующими анализами транскриптов показала значительно повышенную экспрессию факторов SASP, включая IL6, CXCL8, SPINK1, WNT16B (также известен как WNT16), GM-CSF (также известен как CSF2), MMP3 и IL1A, тенденция, сопровождающаяся активацией гена, кодирующего маркер старения p16INK4a у животных, получавших химиотерапию (рис. 5e и расширенные данные Рис. 6c). Эти изменения в основном наблюдались в стромальных клетках, а не в соседних раковых клетках, что подразумевает возможность репопуляции остаточных раковых клеток, которые часто развивают приобретенную устойчивость в поврежденных лечением TME. Однако после введения PCC1 изменения, связанные с SASP, в значительной степени обращались вспять, как показывают анализы транскриптов и RNA-seq (рис. 5f и расширенные данные Рис. 6d). Чтобы исследовать механизмы, лежащие в основе экспрессии SASP у мышей, получавших MIT, мы вырезали опухоли у животных, получавших эти два агента, через 7 дней после доставки первой дозы GSE, момент времени до развития устойчивых колоний. В отличие от лечения плацебо, введение MIT увеличивало повреждение ДНК и апоптоз, тогда как лечение только PCC1 не усиливало (рис. 5 г). Однако, когда животным, получавшим MIT, одновременно вводили PCC1, повреждение ДНК и апоптоз значительно усиливались, что подразумевает усиление цитотоксичности у животных, получавших как химиотерапию, так и сенолитики. В качестве подтверждающего доказательства мы наблюдали повышенное расщепление каспазы 3, типичный признак клеточного апоптоза, когда PCC1 вводили вместе с MIT (рис. 5ч). Затем мы оценили последствия прогрессирования опухоли, сравнив выживаемость различных групп животных с течением времени. В этой доклинической когорте животных наблюдали на предмет роста опухоли, при этом объемное заболевание считалось возникшим после того, как опухолевая нагрузка стала заметной (размер ≥ 2000 мм).3), подход, использованный в предыдущих исследованиях14,49. Мыши, получавшие комбинаторную терапию MIT – PCC1, показали наиболее длительную медианную выживаемость, прожив по крайней мере на 48,1% дольше, чем в группе, получавшей только MIT (рис. 5i, зеленый против синего). Однако лечение только PCC1 лишь незначительно увеличивало выживаемость. Наши данные предполагают, что введение PCC1 само по себе не изменяет рост опухоли и не способствует выживанию животных, тогда как совместное введение PCC1 с MIT имеет значительный синергетический эффект. Следует отметить, что лечение, проведенное в этих исследованиях, оказалось хорошо переносимым животными, поскольку не наблюдалось значительных изменений уровней мочевины, креатинина или печеночных ферментов или массы тела (расширенные данные, рис. 6д, е). Что еще более важно, химиотерапевтические и геропротективные агенты, вводимые в дозах, оптимизированных в этом исследовании, не оказывали значительного воздействия на целостность иммунной системы или тканевый гомеостаз критических органов даже у иммунокомпетентных мышей (дополнительный рис. 6a – c). Эти результаты подтверждают обоснование того, что антивозрастные агенты в сочетании с традиционной химиотерапией могут усиливать ответ опухоли, не вызывая серьезной системной токсичности. Даже небольшое количество стареющих клеток может вызвать физическую дисфункцию у молодых животных.50. Мы спросили, может ли PCC1 избирательно убивать стареющие клетки in vivo и тем самым предотвращать физическую дисфункцию. Чтобы ответить на этот вопрос, мы выполнили параллельную имплантацию эмбриональных фибробластов контрольной и стареющей мыши (MEF, 0,5 × 106 клеток на сторону), конститутивно экспрессирующую люциферазу (LUC+) подкожно сингенным мышам дикого типа (WT). Сразу после имплантации животных обрабатывали PCC1 (20 мг на кг через внутрибрюшинную инъекцию) или носителем (этанол-полиэтиленгликоль 400-Phosal 50 пропиленгликоль (PG) в 10:30:60) в течение 7 дней (рис. 6а). Мы обнаружили, что интенсивности люминесцентного сигнала были значительно ниже у мышей, которым имплантировали стареющие клетки и лечили PCC1, чем у мышей, получавших носитель из однопометников, хотя после обработки мышей, которым трансплантировали LUC, разницы не наблюдалось.+ контрольные клетки (рис. 6б, в), что подтверждает сенолитическую эффективность PCC1 in vivo. а, Схема экспериментальных процедур трансплантации клеток и физических функциональных тестов у 5-месячных мышей-самцов C57BL / 6J. бРепрезентативные изображения, показывающие активность люциферазы in vivo через 2 дня после последней обработки мышей. Шкала линейки 20 мм. c, Люминесценция трансплантированных клеток в процентах относительно средних сигналов у животных, которым вводили носитель. d-ж, Измерение максимальной скорости ходьбы (относительно исходной) (d), височная выносливость (И) и силу хвата (ж) на 5-месячных самцах мышей C57BL / 6J с тестами, проведенными через 1 месяц после последней обработки. г, Схема экспериментального дизайна для трансплантации и измерения физических функций. час-j, Измерение максимальной скорости ходьбы (относительно исходной) (час), височная выносливость (я) и силу хвата (j) у самцов мышей C57BL / 6J в возрасте 28 недель (через 2 недели после последней обработки). к, Кривые годовой выживаемости 17-месячных животных, которым имплантировали 0,5 × 106 контрольные клетки MEF и обработанные носителем (CTRL-носитель), а мышам имплантировали 0,5 × 106 стареющие клетки MEF, обработанные либо носителем (SEN-носитель), либо PCC1 (SEN-PCC1). Красные стрелки, имплантация клеток (на 528-й день возраста) или конец измерения выживаемости (890-й день возраста). п Значения рассчитывались с помощью двусторонних логранговых тестов (Мантеля – Кокса). L, Сравнительная количественная оценка бремени болезни (слева) и бремени опухоли (справа) (показано как медиана с межквартильным размахом) после имплантации стареющих клеток и лечения носителем или PCC1. мПричина смерти животных, которым вводили имплантированные клетки и лечили носителем или PCC1. За d-ж,час-j, данные показаны в виде диаграмм в виде прямоугольников, на которых прямоугольники простираются от 25-го до 75-го процентиля, при этом медиана показана в виде линии посередине, а усы указывают наименьшие и наибольшие значения. За c-ж,час-j, п значения рассчитывались двусторонним т-тесты. Количество животных, п = 5 на группу для c, п = 10 на группу для d-j, п = 27 для к и п = 13 для L,м. NS, п > 0,05; *п <0,05; **п <0,01; ***п <0,001; ****п <0,0001. Затем мы исследовали, может ли уничтожение имплантированных стареющих клеток с помощью PCC1 ослабить патологические явления, в частности физическую дисфункцию. Обработка молодых животных PCC1 после имплантации стареющих клеток в течение 1 недели предотвратила снижение максимальной скорости ходьбы (RotaRod), выносливости при подвешивании (тест на подвешивание) и силы захвата (измеритель захвата), изменений, наблюдаемых в течение 1 месяца после обработки носителем другой группы мышей, несущих стареющие клетки, что согласуется с потенциалом PCC1 для уменьшения физической дисфункции (рис. 6d – f). Введение PCC1 также предотвращало физическую дисфункцию, которая возникала у животных через 5 недель после имплантации стареющих клеток (рис. 6 г). У мышей, несущих стареющие клетки, один 5-дневный курс лечения PCC1 улучшил физическую функцию по сравнению с лечением носителем (рис. 6 утра - д). Следует отметить, что улучшение было обнаружено через 2 недели после лечения PCC1 и даже длилось несколько месяцев (расширенные данные, рис. 7а, б). В эти два момента времени введения PCC1 (сразу по сравнению с 5 неделями после имплантации стареющих клеток) положительные эффекты PCC1, по-видимому, были сопоставимы. Данные предполагают, что график введения PCC1 может быть гибким, что указывает на его потенциальную клиническую осуществимость. Так как процианидины, полученные из семян растений, обычно имеют период полувыведения <12 часов.51,52такое устойчивое улучшение физической функции после однократного курса лечения PCC1 позволяет обойти необходимость в непрерывном лечении сенолитическим агентом, что также подразумевает, что активность PCC1 достаточна для предотвращения физической дисфункции, вызванной стареющими клетками. Затем мы попытались оценить влияние стареющих клеток или пользу их устранения у животных среднего возраста. Для этой цели мы использовали 17-месячных мышей C57BL / 6J, которым имплантировали контрольные или стареющие MEF. Примечательно, что выживаемость животных, несущих стареющие клетки и получавших лечение носителем, в следующем году была значительно ниже, чем у животных, получавших лечение PCC1, с повышенным в 2,4 раза риском смерти (отношение рисков, п = 0,0172) (рис. 6k). Однако бремя болезни, бремя опухоли на момент смерти и причины смерти существенно не различались между мышами, получавшими носитель, и мышами, получавшими PCC1 (рис. 6л, м). Эти данные предполагают, что небольшое количество стареющих клеток может влиять на выживаемость посредством общего процесса, такого как ускорение прогрессирования старения, а не вызывая какую-либо конкретную патологию или несколько индивидуальных состояний. Увеличение количества стареющих клеток приводит к физической дисфункции - тенденции, которая связана со смертностью среднего возраста, но может быть отложена введением сенолитиков, таких как PCC1. Сенолитики истощают стареющие клетки в различных тканях и органах в различных патофизиологических ситуациях, большинство из которых коррелируют со старением.53. Чтобы дополнительно изучить влияние PCC1 на стареющие клетки организмов и старение организма, мы выбрали две независимые животные модели старения in vivo, в том числе мышей, подвергшихся воздействию терапии, и мышей, стареющих естественным путем. Во-первых, мы индуцировали клеточное старение, подвергая мышей WT облучению всего тела (WBI) в сублетальной дозе (5 Гр), после чего следовала геропротекторная обработка PCC1 (20 мг на кг через внутрибрюшинную инъекцию) или носителем (этанол-полиэтилен). гликоль 400 – Phosal 50 PG в 10:30:60) (один раз в неделю) (Рис. 7а). Следует отметить, что животные, подвергшиеся WBI, демонстрировали ненормальный внешний вид тела, включая заметно поседевшие волосы, которые, однако, были в значительной степени устранены введением PCC1 (рис. 7б, в). SA-β-Gal-позитивные стареющие клетки индуцировались in vivo у этих животных, о чем свидетельствует повышенная положительность окрашивания в сердечной и легочной тканях (рис. 7г, д). Однако, когда мы обрабатывали PCC1 путем внутрибрюшинной инъекции, процент SA-β-Gal-позитивных клеток в рассеченных тканях был значительно снижен, в отличие от мышей, получавших носитель, на стадии после WBI (рис. 7f, г). Обработка PCC1 также снижает экспрессию маркеров старения и подмножества ключевых факторов SASP по сравнению с обработкой носителем (рис. 7ч). В целом, данные предполагают, что PCC1 может эффективно истощать SA-β-Gal-положительные клетки, контролировать экспрессию SASP и минимизировать нагрузку стареющими клетками в условиях in vivo у мышей. а, Схема экспериментальной процедуры для мышей, испытывающих WBI и физические функциональные тесты. б, Сравнение снимков всего тела самцов мышей C57BL / 6J, которые были наивными, подвергались воздействию WBI с последующей обработкой носителем или подвергались воздействию WBI и лечились PCC1, соответственно. c, Изображение животных, описанных в а в доклинических условиях. dРепрезентативные изображения окрашивания SA-β-Gal сердечной ткани необработанных (наивных) мышей и мышей, получавших WBI, подвергнутых обработке носителем или PCC1. Шкала 200 мкм. И, Репрезентативные изображения окрашивания SA-β-Gal легочной ткани мышей, как описано в d. Масштабная линейка 200 мкм. ж, Сравнительная статистика окрашивания SA-β-Gal сердечной ткани животных, исследованных в г. d. г, Сравнительная статистика окрашивания SA-β-Gal легочной ткани животных, исследованных в г. И. час, Количественное измерение экспрессии SASP на уровне транскрипции в тканях, взятых у животных, получавших лечение в условиях, описанных в а. я,j, Измерение беговой дистанции на беговой дорожке (я) и силу хвата (j) экспериментальных мышей. За ж-j, п значения рассчитывались двусторонним т-тесты. кАнализ выживаемости Каплана-Мейера мышей C57BL / 6J, подвергшихся воздействию WBI и получавших еженедельно носитель или PCC1, с наивными мышами в качестве необработанного контроля. ДИ - доверительный интервал; ЧСС, степень опасности; DFI, безрецидивный интервал. п Значения рассчитывались с помощью двусторонних логранговых тестов (Мантеля – Кокса). Данные на гистограммах показаны как среднее ± стандартное отклонение и представляют три независимых эксперимента. NS, п > 0,05; *п <0,05; **п <0,01; ***п <0,001; ****п <0,0001. Затем мы оценили влияние доклинического лечения на физические параметры мышей. Как и ожидалось, WBI значительно снизил нагрузочную способность и мышечную силу, измеренную с помощью тестов на беговой дорожке и силы захвата в группе транспортных средств (рис. 7i, j). Напротив, введение PCC1 дало существенную пользу, восстанавливая эти возможности. Что еще более важно, лечение PCC1 увеличивало выживаемость (рис. 7k). Наши результаты показывают, что вызванное PCC1 устранение SA-β-Gal-позитивных стареющих клеток может быть эффективной стратегией для облегчения физического регресса, связанного со старением, и снижения смертности в условиях преждевременного старения, вызванного факторами окружающей среды, такими как цитотоксическая терапия. Затем мы попытались определить влияние стареющих клеток на физические функции у естественно стареющих животных. С этой целью мы лечили нормальных 20-месячных мышей WT носителем (этанол – полиэтиленгликоль 400 – Phosal 50 PG в 10:30:60) или PCC1 (20 мг на кг через внутрибрюшинную инъекцию) (один раз в 2 недели). за 4 месяца (рис. 8а). Гистологическая оценка выявила значительно повышенный процент SA-β-Gal-положительных стареющих клеток в почках, печени, легких и предстательной железе старых животных, что было устранено обработкой PCC1 (рис. 8б, в и расширенные данные Рис. 8a – f). Результаты физических испытаний показали, что PCC1 облегчает физическую дисфункцию за счет увеличения максимальной скорости ходьбы, выносливости при висении, силы захвата, выносливости на беговой дорожке, дневной активности и показателей баланса пучка у животных, которым вводили PCC1, по сравнению с животными, получавшими носитель (рис. 8d – i), Масса тела и потребление пищи оставались в значительной степени неизменными у мышей, получавших PCC1 (расширенные данные, рис. 8г, ч). Примечательно, что экспрессия SASP была значительно снижена в тканях, таких как легкие старых мышей, получавших PCC1, по сравнению с таковой в группе, получавшей носитель (фиг. 8j), что соответствует меньшей секреции факторов SASP стромальными тканями человека, обработанными PCC1 (рис. 5f). а, Схематический дизайн для физического осмотра 20-месячных мышей-самцов C57BL / 6J, получавших PCC1 один раз каждые 2 недели (раз в две недели) в течение 4 месяцев. бРепрезентативные изображения окрашивания почек SA-β-Gal у молодых и старых мышей, получавших носитель или PCC1. Шкала 200 мкм. c, Количественная оценка окрашивания SA-β-Gal, как описано в б. Данные представляют собой среднее значение ± стандартное отклонение d-час, Количественная оценка максимальной скорости ходьбы (относительно базовой) (d), височная выносливость (И), сила хвата (ж), выносливость на беговой дорожке (г) и повседневная активность (час) 20-месячных мышей-самцов C57BL / 6J после 4-месячного лечения. я, Количественное определение времени, необходимого для пересечения балансира. Точки данных до и после лечения каждого животного соединяются для прямого сравнения эффектов лечения. j, Количественное профилирование транскриптов экспрессии SASP в тканях легких, собранных у 6-месячных необработанных (6M), 24-месячных мышей, получавших носитель (24M-носитель), и 24-месячных мышей, получавших PCC1 (24M-PCC1) . Данные представлены как среднее ± стандартное отклонение и были получены из трех биологических повторов (п = 3 независимых анализа). к, Схематический дизайн для анализа продолжительности жизни мышей (обоих полов) в возрасте 24–27 месяцев. L,м, Выживаемость после лечения (L) и выживание в течение всей жизни (м) кривые животных C57BL / 6J, получавших два раза в неделю PCC1 (п = 91; 48 мужчин, 43 женщины) или транспортное средство (п = 80; 42 мужчины, 38 женщин) в возрасте от 24 до 27 месяцев. п, Максимальная скорость ходьбы и выносливость в висе в среднем за последние 2 месяца жизни (п = 10 мышей на группу) и продолжительность жизни самых долгоживущих мышей (топ-20) в обеих группах. В, Бремя заболевания и бремя опухоли на момент смерти. Для обоих полов п = 60 мышей на руку. Для мужчин, п = 31 для PCC1 и п = 33 для автомобиля. Для женщин, п = 29 для PCC1 и п = 27 для автомобиля. За c-час,j, п = 3 биологически независимых теста. Данные отображаются в виде графиков в виде прямоугольников с усами, на которых прямоугольник простирается от 25-го до 75-го процентиля, при этом медиана отображается в виде линии посередине, а усы указывают наименьшие и наибольшие значения (d-час,п) или как среднее ± стандартное отклонение (В). Непарный двусторонний т-тесты (c-j,п,В) и модели регрессии пропорциональных рисков Кокса (L,м) были использованы для определения статистической значимости. Чтобы установить потенциал элиминации стареющих клеток для продления оставшейся продолжительности жизни мышей WT, мы провели лечение PCC1, начиная с очень пожилого возраста (рис. 8k). У мышей, получавших введение PCC1 (один раз в 2 недели или раз в две недели), начиная с возраста 24–27 месяцев (примерно эквивалентно возрасту 75–90 лет у людей), средняя продолжительность жизни после лечения была на 64,2% больше (или на 9,4% больше в целом). продолжительность жизни) и более низкий риск смертности (65,0%, п <0,0001), чем в группе, получавшей носитель (рис. 8л, м). Эти данные показывают, что PCC1 может значительно снизить риск возрастной смертности у старых мышей. Затем мы спросили, не произошло ли снижение смертности пожилых животных за счет увеличения заболеваемости в позднем возрасте. Мы измеряли физическую функцию у экспериментальных мышей, получавших PCC1 или носитель ежемесячно до смерти. Несмотря на большую оставшуюся продолжительность жизни у мышей, получавших PCC1, физическая функция в последние 2 месяца жизни не была значительно ниже, чем у мышей, получавших носитель (рис. 8n). При аутопсии частота нескольких возрастных патологий, опухолевое бремя и причина смерти существенно не различались между мышами, получавшими PCC1, и мышами, получавшими носитель (рис. 8o и расширенные данные Рис. 9а, б). Однако экспрессия SASP была снижена в твердых органах, что было в значительной степени совместимо со снижением циркулирующих уровней интерлейкина (IL) -6, колониестимулирующего фактора (CSF) 2 и моноцитарного хемоаттрактантного белка (MCP) 1, репрезентативных маркеров SASP. в периферической крови (расширенные данные рис. 9c - f). Мы также наблюдали снижение экспрессии SASP в CD3.+ Т-клетки периферической крови (расширенные данные рис. 9 г), клеточной линии, которая демонстрирует устойчивое увеличение p16INK4a выражение во время старения человека54. Кроме того, обработка PCC1 снижает окислительный стресс в тканях печени, о чем свидетельствует уменьшение аддуктов продукта перекисного окисления липидов 4-гидроксиноненаля (HNE) и увеличение соотношения восстановленного и окисленного глутатиона (расширенные данные, рис. 9ч, я), что согласуется с общими свойствами флавоноидов, которые проявляют антиоксидантную активность, противодействуя свободным радикалам и задействуя систему антиоксидантной защиты.55,56. Таким образом, сенолитический агент PCC1, фитохимический компонент, полученный из GSE (или, в меньшем количестве, из натуральных продуктов, таких как экстракты корицы, какао, яблочной кожуры и сосновой коры), может уменьшить нагрузку на стареющие и, возможно, другие клетки. развивают провоспалительный фенотип и по своей природе зависят от антиапоптотических путей, связанных со старением, способствующими выживанию, и увеличивают продолжительность жизни после лечения, не вызывая повышенной заболеваемости у мышей. Настоящим мы представляем принципиальное доказательство того, что даже при применении в пожилом возрасте такой терапевтический метод обладает значительным потенциалом для значительного замедления возрастной дисфункции, уменьшения возрастных заболеваний и улучшения состояния здоровья, тем самым открывая новые возможности для улучшения продолжительность здоровья и продолжительность жизни в гериатрической медицине будущего. Старение - это, по сути, неизбежный процесс, который постепенно вызывает функциональное снижение почти у всех организмов. Клеточное старение, состояние необратимой остановки роста, недавно стало одновременно признаком и движущей силой старения.3,57. Стареющие клетки со временем накапливаются в стареющих тканях и способствуют увеличению списка патологий.58. Удаление стареющих клеток из прогероидных мышей или мышей естественного возраста продлевает срок их здоровья, увеличивает продолжительность жизни и сдерживает возрастные расстройства, включая, помимо прочего, атеросклероз, остеоартрит и нейродегенеративные заболевания.59,60,61,62. Недавние успехи в исследованиях, связанных с возрастом, побудили к поиску лекарств, которые могут избирательно воздействовать на стареющие клетки, в частности, новый класс геропротекторных агентов, называемых сенолитиками или, что менее агрессивно, сеноморфизмом. На сегодняшний день сообщается о нескольких сенолитиках, включая дазатиниб и кверцетин, физетин, пиперлонгумин, ингибиторы белка теплового шока (HSP) 90 и ингибиторы семейства BCL-2, такие как ABT-263 (navitoclax) и ABT-737 (исх. 11,12,13,18,19,21,22). Среди них ингибиторы BCL-2 являются наиболее широко используемыми сенолитиками, хотя изначально они были разработаны для лечения лимфомы. ABT-737 нацелен на BCL-2, BCL-xL и BCL-w, но с низкой растворимостью и пероральной биодоступностью. Более эффективный для использования in vivo, ABT-263 в основном ингибирует BCL-2 и BCL-xL, тогда как он часто вызывает тромбоцитопению. Учитывая выраженные побочные эффекты некоторых сенолитических соединений, существует потребность в идентификации новых соединений с сенолитической активностью, но пониженной цитотоксичностью. В этом исследовании мы проверили библиотеку лекарств на основе PDMA, состоящую в основном из натуральных продуктов, с целью выявления новых агентов, которые могут широко воздействовать на стареющие клетки с оптимальной эффективностью и безопасностью in vivo. В результате мы определили PCC1, фитохимический агент, полученный из природных источников, как сенолитическое соединение широкого спектра действия. В качестве особого преимущества В качестве альтернативы PCC1 может действовать как сеноморфный агент для минимизации экспрессии SASP при использовании в низких концентрациях. Такая полезная особенность PCC1 действительно во многом напоминает GSE, который может вызывать как сеноморфные, так и сенолитические эффекты. Генетические и фармакологические стратегии продемонстрировали ряд преимуществ устранения стареющих клеток для замедления старения и контроля заболеваний. Клеточное старение может быть вызвано множеством стимулов, от онкогенной активации, генотоксического стресса до воспалительной реакции и репликативного истощения. Некоторые соединения идентифицированы как сенолитики широкого спектра действия, в то время как другие являются селективными только против определенного типа стареющих клеток. Различия в специфичности подразумевают индивидуальный выбор сенолитиков, который в основном зависит от их предполагаемого клинического применения. Недавнее исследование показало, что уабаин, природное соединение, принадлежащее к семейству сердечных гликозидов, является сенолитическим агентом, который можно использовать как для устранения стареющих клеток, так и для лечения рака, причем последнее реализуется посредством двойного механизма действия.63. В этой работе мы обнаружили PCC1 как еще один новый, природный и мощный сенолитик, который избирательно и специфически индуцирует апоптоз стареющих клеток, но с ограниченной цитотоксичностью по отношению к пролиферирующим клеткам.64. Следует отметить, что при более низких концентрациях PCC1 подавляет экспрессию SASP, свойство, присущее некоторым флавоноидам растительного происхождения, таким как апигенин и кемпферол, которые могут действовать как сеноморф, ограничивая влияние стареющих клеток на возрастные состояния.65,66. Хотя несколько исследований раскрыли такой двойной механизм воздействия природных агентов на стареющие клетки, недавно синтезированный кверцетин с функционализированной поверхностью Fe3В4 наночастицы проявляют как сенолитический, так и сеноморфный потенциал в фибробластах человека за счет усиления активности AMP-активированной протеинкиназы (AMPK).67. Механизм, с помощью которого PCC1 достигает сенолитических эффектов, кажется сложным и требует дальнейшего изучения. Наши данные предполагают, что PCC1 нарушает функциональную целостность митохондрий, нарушая Δψm, что приводит к увеличению продукции свободных радикалов, таких как ROS, и вызывает высвобождение цитохрома с в стареющих клетках, но не в пролиферирующих клетках. Возможная причина этой специфичности заключается в том, что стареющие клетки имеют тенденцию к развитию деполяризованной плазматической мембраны и имеют повышенные концентрации H+ (исх. 64), функция, которая может сделать их более восприимчивыми к действию PCC1. Следует отметить, что эти изменения сопровождаются повышенной экспрессией проапоптотических факторов, в частности NOXA и PUMA, событий, которые также критически способствуют апоптозу стареющих клеток. В семействе процианидинов, члены которого, как известно, происходят в результате полимеризации молекул флаван-3-ола и существуют в виде олигомеров или полимеров.28, PCC1 кажется функционально уникальным. Наши экспериментальные данные указывают на заметную разницу между PCC1 (тримером) и другими процианидинами (большинство из которых действительно являются мономерами или димерами, такими как PCB2). Поскольку мы не проводили всестороннего анализа членов семейства процианидинов, вопрос о том, определяет ли количество мономеров в молекуле ее потенциал против старения, остается открытым, но интригующим вопросом, а лежащие в основе механизмы заслуживают продолжения исследований в будущем. Клеточное старение само по себе представляет собой весьма неоднородный процесс, который зависит от различного происхождения клеток и факторов окружающей среды.68. Одной из ключевых особенностей PCC1 является его способность эффективно очищать стареющие клетки от широкого спектра типов клеток и стрессоров, включая репликацию, онкогены, облучение и химиотерапию. В этом исследовании мы сравнили PCC1 с другими зарегистрированными сенолитиками на предмет воздействия на стромальные клетки человека, фибробласты, HUVEC и MSC, основные типы клеток в тканевом микроокружении. Как сообщалось, ABT-263 устраняет стареющие эмбриональные фибробласты человека (HEF) и HUVEC, но оказывает незначительное влияние на преадипоциты человека.12,18. Комбинированное применение дазатиниба и кверцетина может истощить все три типа стареющих клеток дозозависимым образом, но токсично для пролиферирующих клеток.11,69,70. Физетин, еще один природный флавоноид, о котором сообщается как о сенолитическом средстве, проявляет умеренное воздействие на стареющие HEF и преадипоциты только в высоких концентрациях.20,21. Напротив, PCC1 может преодолеть эти ограничения, в том числе зависимость от типа клеток, высокую токсичность для не стареющих клеток и низкую эффективность против стареющих клеток. Хотя при использовании отдельно кверцетин (еще один флавоноид в GSE) сам по себе проявляет цитотоксичность в отношении стареющих стромальных клеток, его эффективность обычно ниже, чем у PCC1 (сравните рис. 2а, в и дополнительные фиг. 3n и 4n). Вместе PCC1 обладает превосходной сенолитической активностью с высокой специфичностью и эффективностью для более широкого диапазона типов клеток, чем многие зарегистрированные сенолитики, такие как ABT-263, дазатиниб, кверцетин и физетин, и может воздействовать на стареющие клетки, генерируемые несколькими основными типами индукторов старения. Мы обнаружили, что PCC1 оказывает индуцирующее апоптоз действие на стареющие клетки в условиях in vivo. PCC1 эффективно устраняет вызванные терапией стареющие клетки и снижает маркеры старения в твердых органах, подчеркивая его эффективность in vivo. В этом исследовании мы также лечили мышей естественного возраста с помощью PCC1 и тестировали его влияние на стареющие клетки, хроническое воспаление и физические функции. Во-первых, обработка PCC1 приводила к истощению стареющих клеток во многих тканях и уменьшению сигнатур, связанных с SASP, как показал анализ GSEA. Во-вторых, PCC1 может подавлять экспрессию SASP-ассоциированных генов в пожилой печени и почках и уменьшать хроническое воспаление слабой степени в крови. В-третьих, PCC1 облегчает нарушение двигательной функции, равновесия, утомленные упражнения, мышечную силу и спонтанное исследование у старых мышей. Самое главное, эффективность RotaRod и тестирования баланса пучка в группе, обработанной PCC1, была улучшена по сравнению с таковой в исходных условиях предварительной обработки. В совокупности фитохимическое соединение PCC1 избирательно воздействует на стареющие клетки в тканевом микроокружении и оказывает замечательные биологические эффекты у мышей в естественном возрасте. Подобно химически синтезированным аналогам, процианидины природного происхождения проявляют противовоспалительную, противоартритную, противоаллергическую и противоопухолевую активность, улавливают свободные радикалы кислорода и подавляют активность перекисного окисления, вызванного излучением.36,71. Было показано, что как тример эпикатехина, выделенный из растительного материала, в первую очередь из косточек винограда, приносит пользу для здоровья при хронических патологических состояниях.72. Однако тщательная оценка токсикологических эффектов PCC1 in vivo имеет решающее значение для потенциального клинического применения. Наши данные показали, что лечение PCC1 с высокой концентрацией (20 мг на кг) и с высокой частотой (раз в две недели) не оказывало явной системной токсичности. Таким образом, наше исследование демонстрирует превосходство и относительную безопасность геропротекторной стратегии, которая избирательно воздействует на стареющие клетки в старых или поврежденных лечением тканях по широкому спектру типов клеток. Однако возможно, что концентрации PCC1 in vivo варьируются между органами и зависят от вводимой дозы, фармакодинамики и фармакокинетики, и что локальные концентрации недостаточно высоки для достижения сенолитического эффекта в некоторых типах тканей. В таком случае, В целом, наше исследование открывает новые возможности для увеличения продолжительности здорового образа жизни и продолжительности жизни, а также для лечения возрастных патологий с помощью сенотерапевтического агента (как с сеноморфным, так и с сенолитическим потенциалом), полученного из природных источников и обладающего выраженной эффективностью. Потенциальные антивозрастные эффекты PCC1, продемонстрированные в наших доклинических исследованиях, обеспечивают хорошую поддержку для дальнейшей трансляции и клинической разработки PCC1 с общей целью достижения более продолжительной и здоровой жизни.Главный
Результаты
Низкие концентрации GSE сдерживают экспрессию SASP
GSE обладает сенолитической активностью при высоких концентрациях.
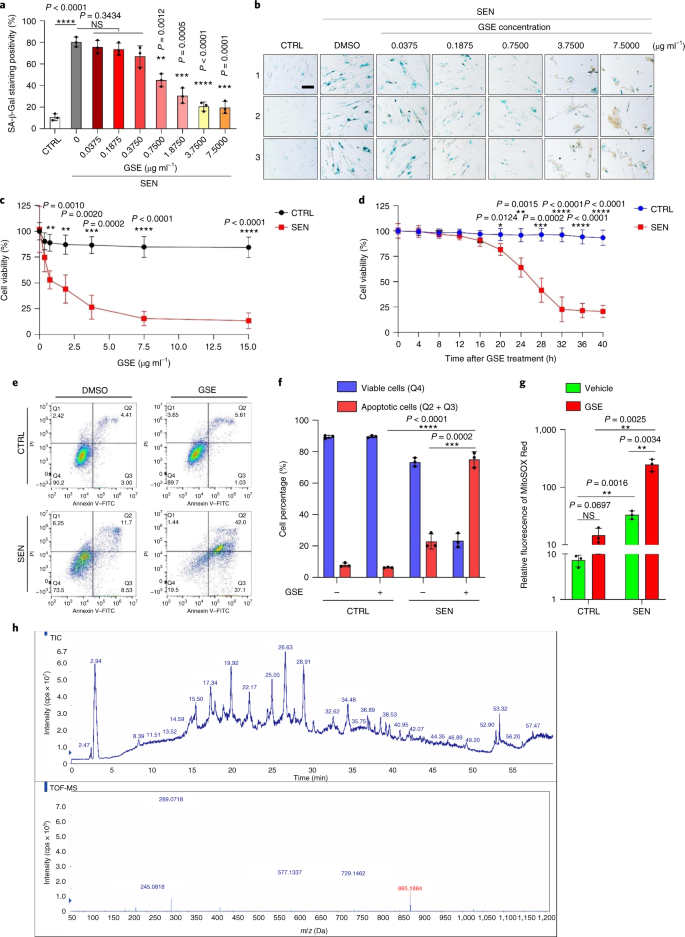
Компонент PCC1 GSE обладает сенолитической активностью.
PCC1 вызывает митохондриальную дисфункцию в стареющих клетках
PCC1 способствует регрессии опухоли и снижает химиорезистентность

Удаление стареющих клеток в результате лечения PCC1 облегчает физическую дисфункцию
PCC1 поддерживает физическую функцию и продлевает выживаемость старых мышей.
Обсуждение




